
一、病史及辅助检查:甲流阳性,入院后ARDS,如何串联线索全面诊断?
患者为67岁男性,于2025年1月10日入院。8天前,出现发热,最高体温38.5℃。伴干咳、流涕、打喷嚏、头痛。4天前,出现上述症状加重,并出现气短。胸部CT提示双肺多发渗出性病灶,间质性改变。于当地医院住院,查甲流核酸提示阳性,给予“帕拉米韦、头孢哌酮钠舒巴坦钠+莫西沙星”治疗。1月10日入院,气短进行性加重,复查胸部CT提示双肺渗出加重,转入我院。
既往史和个人史:患者10年前诊断“2型糖尿病”,给予“二甲双胍缓释片”治疗;10年前诊断“高血压病”,最高170/90mmHg,目前“硝苯地平缓释片II”治疗;15年前因胃出血行“胃部分切除术”。吸烟30年,每日约20支,无饮酒史,无食物药物过敏史。
查体:T37.8℃,RR32次/分(呼吸频率明显升高),HR105次/分,血压151/80mmHg,指脉氧68%(明显下降),听诊双肺呼吸音粗,可闻及散在爆裂音,心腹查体未见异常,双下肢无水肿,无四肢关节疼痛及变形。
入院后,我们完善了相关检查:
胸部CT(01-10):双肺多发渗出实变,两肺间质纤维化,可见多发小结节影。
血气分析:在高流量湿化氧疗流速50升/分、浓度100%的情况下,FI02 (100%):PH7.443,二氧化碳分压25.6mmHg,氧分压66.5mmHg,钙1.13mmol/1,乳酸4.6mmol/,碳酸氢根17.5mmil/L,氧合指数66.5mmHg。
血常规:白细胞和淋巴细胞明显降低,W 3.36*10^9/L,N 2.6*10^9/L,L 0.56*10^9/L,中性粒细胞比例77.4%,淋巴细胞比16.6%,血小板211*10^9/L。
肝肾功能:没有特别异常,存在低钠血症。总蛋白70.5g/1,白蛋白36.8g/1,ALT 20u/1,AST 44u/1,钠126mmol/1,氯98mmol/1,血糖 17mmol/L。
凝血及纤溶指标:D二聚体18.61ug/mL,纤维蛋白原降解产物46.7ug/mL,APTT 39.6s。
感染指标: ESR 101mm/h;PCT 2.54ug/ml;IL-6 38pg/ml;SAA 389.56mg/L,CRP51mg/L。
病毒核酸检测:甲型流感病毒核酸阳性,新冠病毒核酸检测阴性。
其他心肌损伤标志物、BNP指标均阴性。心电图提示部分导联ST-T改变(I、II、avL、avF、V2-V6)。
胸部超声:右肺下肺区及左肺上侧、下肺区可见胸膜线中断,多条不均匀B线,胸膜线下肺内可见大片肺实变影,提示ARDS肺水肿表现。
心脏超声:左心室射血分数为57%,高位乳头肌水平以下左室前壁、侧壁、前间壁运动搏幅减低,各瓣膜厚度、弹性、开放幅度未见异常;左室舒张迟缓功能减低,收缩功能正常,心包膜未见明显增厚。
因为患者D二聚体和纤维蛋白原降解产物都明显升高,所以我们做了双下肢静脉超声,并未提示血栓形成,双下肢肌间静脉内径局限性增宽,血流速减低;下腔静脉超声提升下腔静脉塌陷率50%,提示容量相对不足。
胸片:双肺大片状密度增高影,多考虑感染性病变。
这是患者在外院拍的胸部CT(01-10),显示双肺多发实变、渗出、磨玻璃样改变以及结节影。

串联起各种线索,我们面临诊断的问题:
根据相关检查,患者的各项评分如何?APACHEII为19分,SOFA为4分,提示脓毒血症,静脉血栓风险因素评分(Padua)为6分。
ARDS 2012柏林定义、2023指南、Global定义诊断标准比较:

2023 ARDS诊断及非机械通气治疗指南发布的新定义拓宽了ARDS的诊断范围,允许SpO2/FiO2≤315 mmHg同时 SpO2≤97% (SpO2/FiO2在SpO2>97%时无效)作为低氧血症的判定标准。
患者发热时间为8天,气短加重时间为4天。胸部CT显示双肺多发渗出病灶,超声则提示ARDS肺水肿表现。病人高流量湿化氧疗流速为50升/分,FIO2 100%,氧合指数仅为66.5毫米汞柱。
据此可以做出初步诊断
急性呼吸窘迫综合征(重度)
脓毒血症
重症肺炎
间质性肺炎
高乳酸血症
高血压病2级(高危)
2型糖尿病
二、治疗及指标变化:真菌指标明显升高,患者病情危重,暂时缓解后反复
我们整理了2023 ARDS诊断及非机械通气治疗指南的推荐意见:
推荐条目
适用人群/场景
干预方案
1. 糖皮质激素
中重度ARDS
泼尼松当量1-2 mg/kg/d,疗程≤1周(根据临床调整)
2. 中性粒细胞弹性蛋白酶抑制剂
轻中度ARDS
西维来司他钠4.8 mg/(kg·d),疗程≤14天(联合常规治疗)
3. 抗凝治疗
低出血风险(HAS-BLED 0-2分)
低分子肝素2500-5000 U/d(皮下);肌酐清除率<30 mL/min禁用
4. NO吸入
重度ARDS(设备条件允许时)
常规治疗基础上加用
5. 限制性液体管理
ARDS患者(循环稳定时)
限制性补液策略
6. ECCO₂R
中重度ARDS(无凝血障碍/出血风险,设备可行)
常规治疗基础上实施
指征:驱动压≥15 cmH₂O、呼吸频率>30次/min、pH<7.25且无需ECMO
7. 俯卧位通气
中重度ARDS
每日≥12小时
8. HFNO
拔管后ARDS患者
优先选择经鼻高流量氧疗(动态调整)
9. 肺部超声
疑似ARDS患者:
作为辅助诊断/评估工具
①筛查(注意假阳性/阴性)
②替代X线/CT(不可及或转运高危)
③日常评估
患者入院前已经使用头孢哌酮舒巴坦联合莫西沙星以及帕拉米韦抗感染治疗,患者胸部CT及气短仍有明显进展。因此入院后考虑到患者病情危重,我们升级为美罗培南+利奈唑胺葡萄糖注射液(覆盖阴性杆菌和球菌)+玛巴洛沙韦(抗病毒治疗)。抗炎方面给予甲泼尼龙40mg bid+西维来司他钠。氧疗方面采取高流量经鼻氧疗(流速50L/min FIO2 100%),抗凝治疗采用低分子肝素钙 2500单位q12h +双下肢气压治疗,其他治疗包括胸腺法新、抑酸、补钙,俯卧位通气大于12小时。
入院治疗后续指标变化:真菌指标方面,G实验 188.3pg/ml,G实验 1.6S/CO;IgE 276.95IU/ml,都明显升高。血气分析方面,FIO2 (给氧浓度下降至80%):PH7.450,二氧化碳分压31.9mmHg,氧分压85.4mmHg,乳酸2.6mmol/,碳酸氢根22.1mmol/L,氧合指数升至106.75mmHg。免疫相关指标:抗CCP抗体 62.51%;抗核抗体阳性;类风湿因子、自身抗体、血管炎组合均阴性。凝血及纤溶方面,经过抗凝治疗有所下降:D二聚体12.84ug/mL,纤维蛋白原降解产物32ug/mL。其余指标如糖化血红蛋白7.9%,空腹血糖11-13mmol/L(明显升高),餐后2小时血糖12-18mmol/L(同样明显升高)。
2023年詹庆元教授团队曾发表研究,研究提示,2022年12月1日-2023年2月28日,123 例 COVID-19 患者中 36 例诊断为COVID-19相关肺曲霉病(CAPA),多为男性,免疫抑制患者占比高,接受高级呼吸支持比例高,ICU 住院时间长,死亡率达 66.7%。CAPA 是 COVID-19 危重患者常见并发症,死亡率高。固体器官移植、APACHE II 评分≥20 分和 5 分≤SOFA 评分 < 10 分是独立危险因素。CAPA 诊断依赖微生物学证据,应尽早获取 BALF。BALF GM 诊断效能高,mNGS 可辅助早期诊断,但研究存在局限性。(Frontiers in Cellular and Infection Microbiology,2023,13)

结合指标及相应研究,我们做了补充诊断:
补充诊断
肺曲霉菌病
双肺间质纤维化
类风湿性关节炎?
调整治疗方案(01-13):
考虑到目前患者氧需求较高、给氧浓度较高,病情较危重,所以加入伏立康唑注射液 0.3g q12h(首剂0.45g)抗真菌治疗;
在间质性肺炎方面,给予吡非尼酮胶囊 200mg tid;
患者入院时,抗CCP抗体、抗核抗体阳性,类风湿因子阴性,且没有关节疼痛肿胀的表现,因此暂时将甲泼尼龙从80 mg qd调整为40mg qd,并且给予降糖,门冬胰岛素4-4-4三餐前。
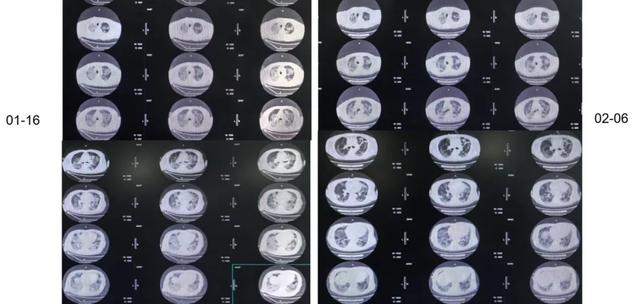
经过治疗后,1月16日我们复查胸部CT,可以看到病灶较前有所吸收。

进一步检查,患者的氧合也逐渐改善,1月17日,FIO2 下调至60%:PH7.479,二氧化碳分压32mmHg,氧分压70mmHg,乳酸2.4mmol/,碳酸氢根23mmol/L,氧合指数升高至116mmHg。我们进行了床旁气管镜,镜下可见气管及左右主支气管较多白色粘痰,给予吸引后可见左右各级支气管管腔通畅,黏膜充血水肿,未见新生物。
1月18日,灌洗液结果提示,真菌核酸检测:曲霉菌属DNA 28.543(阳性);GM实验3.1S/CO(阳性);NGS 曲霉菌;灌洗液涂片:G阴性杆菌;灌洗液细菌培养阴性。
1月20日,患者的感染指标明显改善,血常规:W 8.26*10^9/L,N 7.27*10^9/L,L0.94*10^9/L,N%87.7%,L%11.3%,血小板370*10^9/L;CRP、IL-6、PCT正常。
因此我们调整治疗方案,伏立康唑+哌拉西林钠他唑巴坦钠(01-20)继续抗真菌治疗,甲泼尼龙抗炎逐渐减量至 20mg qd,吡非尼酮胶囊增加至300mg tid抗纤维化(患者无特殊不适)。
此时病情反复,1月26日,患者开始出现气短明显加重,不能耐受活动,逐渐调整高流量湿化氧疗参数(流速50L/min FIO2 90%)。血气分析(FIO2 90%):PH7.530,二氧化碳分压33.3mmHg,氧分压56.2mmHg,乳酸1.2mmol/,碳酸氢根27.7mmol/L,氧合指数下降至62.4mmHg。
复查血常规等指标发现,患者白细胞明显升高,IL-6和CRP也出现升高:血常规:W 13.74*10^9/L,N 9.02*10^9/L,L 1.6*10^9/L,N%79.2%,L%14.7%,血小板377*10^9/L;CRP68.33mg/L; IL-6 62pg/ml; PCT阴性。
患者突然出现气短加重,我们在考虑是否为卧床状态导致肺栓塞,下肢B超并未看到双下肢静脉血栓,凝血及纤溶指标方面:DD 1.78ug/ml(比入院及后续复查时明显下降),APTT 42.8s,余正常;心肌损伤标志物、BNP正常,因此考虑急性心衰、急性肺栓塞的依据均不足。
1月26日再次复查CT,与1月16日相比,双肺下叶实变增加。

这时我们在床旁做了气管镜,发现痰液增多,左右各级支气管可见大量白色粘痰,给予吸引后可见管腔通畅,黏膜充血肿胀,未见新生物。考虑到患者仍然感染加重,我们调整了抗感染治疗,为美罗培南+利奈唑胺葡萄糖注射液+伏立康唑。
同时复查了结缔组织病的相关指标,抗CCP抗体:31.19 RU/ml(01-13 62.51RU/ml)。类风湿因子阴性。
1月28日,灌洗液呼吸道病原体PCR:嗜麦芽窄食单胞菌(+)、屎肠球菌(+),未检见耐药基因。因此我们调整了抗感染治疗方案,停用美罗培南,加用头孢哌酮舒巴坦联合复方新诺明针对嗜麦芽窄食单胞菌、利奈唑胺覆盖屎肠球菌、伏立康唑继续抗真菌治疗、泼尼松减量到15mg。
我们采用了高流量湿化氧(流速50L/min FIO2 80-90%)。血气分析FI02 (80%):PH7.428,二氧化碳分压42.6mmHg,氧分压58.7mmHg,乳酸2.2mmol/,氧合指数73.3mmHg。
为何氧合改善不佳?
细菌感染
病毒感染
结缔组织病
感染指标明显下降:血常规:W 9.01*10^9/L,N 8.43*10^9/L,L 0.5*10^9/L,N%93.6%,L%5.5%,血小板275*10^9/L;CRP35.2mg/L; IL-6 47pg/ml; PCT持续阴性。甲流病毒核酸检测转阴。
灌洗液培养:嗜麦芽窄食单胞菌:头孢他啶、氯霉素、左氧氟沙星、米诺环素、复方新诺明均敏感。
自身免疫指标:由于患者气短缓解不明显,我们检测了特发性炎性肌病谱:抗核抗体 胞浆颗粒型1:320(+),核颗粒型1:100(+),抗PM-Sc175抗体IgG(+)。
患者的给氧浓度无法降低,需要维持在80-90%,患者氧合改善不明显的原因是?细菌感染没有控制住?病毒感染?但复查发现感染指标有所下降。或是结缔组织病继发的肺间质纤维化?结缔组织病考虑是类风湿性关节炎还是系统硬化病?患者的抗CCP抗体一直为阳性,入院血沉也增快(抗CCP抗体:31.19 RU/ml,1月13日62.51RU/ml、ESR101mm/h)。类风湿因子、自身抗体、血管炎组合均阴性,并没有关节疼痛肿胀的表现。
患者会不会是类风湿性关节炎?除前文所述抗PM-Sc175抗体IgG(+)等,病史也给出提示:1年前偶尔有晨僵、右手指关节肿胀。胸部CT示:弥漫性结节影,肺泡实变、小叶间隔增厚、磨玻璃影等。
在后续治疗中,我们将甲泼尼龙再次调到40mg qd,抗纤维化吡非尼酮胶囊 400mg tid。考虑患者目前仍为细菌、真菌混合感染状态,暂未加免疫抑制剂。同时,加入肺康复治疗——呼吸生理治疗、肌肉训练(全身性运动和呼吸肌锻炼),并加强营养支持治疗。调整治疗方案后,患者气短有所减轻,给氧浓度也逐渐下降。
我们在2月6日复查胸部CT,发现与1月16日和1月26日相比,双肺渗出实变明显减轻。
回顾治疗过程中的用药情况、氧合变化:


患者氧合指数从入院时的66.5mmHg,1月20日达到128 mmHg的较好状态后逐渐下降,再次调整后升至218 mmHg。患者使用鼻导管吸氧3-4升,感染指标、血沉指标也基本降至正常后前往风湿免疫科进行专科治疗。
对于呼吸科而言,这个病例提示了我们重点关注哪些方面?
三、从11处要点看病毒性肺炎后肺纤维化
1、病毒肺炎的临床转归?
常见病毒类型及肺损伤关联为:1)SARS- CoV- 2、流感病毒等常见,急性期引起肺泡炎,损伤肺泡上皮,为慢性纤维化奠定基础。2)病毒直接破坏肺泡结构,引发炎症风暴,导致肺组织修复异常,形成纤维化。
2、间质纤维化的定义与分类
病毒肺炎后纤维化(PVPF)具有特殊性:继发于病毒感染,与特发性肺纤维化不同,病理特征为肺泡结构紊乱、胶原沉积。常伴有炎症细胞浸润,与病毒感染后的免疫反应密切相关,预后受多种因素影响。
3、流行病学数据
发生率与高危因素:COVID- 19后约5- 20%患者出现纤维化,高龄、机械通气、基础肺病等是高危因素。高危人群需密切监测肺功能,早期干预可降低纤维化发生率,改善预后。
4、病理生理机制
1)病毒直接损伤:病毒入侵肺泡上皮细胞,诱导细胞凋亡,破坏基底膜完整性,使炎症细胞易于浸润。肺泡上皮细胞凋亡后,基底膜受损,影响肺泡修复,促进纤维化发生。
2)免疫异常反应:
-细胞因子风暴(IL-6, TGF-β等):病毒感染引发细胞因子风暴,IL- 6、TGF- β等大量释放,激活成纤维细胞,促进纤维化。细胞因子风暴导致炎症反应失控,加重肺组织损伤,推动纤维化进程。
-巨噬细胞极化(M1/M2失衡):巨噬细胞极化失衡,M1型增多,释放促炎因子,M2型减少,抑制炎症和修复功能受损。巨噬细胞极化失衡影响炎症消退和组织修复,促进纤维化形成。
3)纤维化修复机制:
-成纤维细胞活化与ECM沉积:成纤维细胞被激活后,大量合成和分泌细胞外基质(ECM),如胶原蛋白,导致肺组织僵硬,影响通气功能。ECM过度沉积改变肺组织结构,阻碍气体交换,加重呼吸困难。
-上皮-间质转化(EMT)的关键作用:EMT使肺泡上皮细胞转化为间充质细胞,失去上皮特性,获得成纤维细胞功能,促进纤维化。EMT是纤维化关键环节,抑制EMT可减轻纤维化程度。
4)信号通路:
TGF- β激活Smad通路,促进成纤维细胞活化和ECM合成,是纤维化核心信号通路。“TGF- β/Smad通路”过度激活,导致纤维化持续进展,是治疗靶点。“Wnt/β- catenin通路”在肺组织修复和纤维化中起重要作用,调节细胞增殖和分化。该通路异常激活与纤维化密切相关,抑制其活性可减轻纤维化。
5、急性期与纤维化期病理差异
急性炎症期病理特征:表现为肺泡水肿、透明膜形成、炎性细胞浸润,病理改变主要集中在肺泡腔内,以液体渗出和炎性细胞聚集为主。此阶段肺泡结构受损,气体交换受阻,患者常出现呼吸困难、低氧血症等症状。
纤维化期病理特征:出现肺泡间隔增厚、成纤维细胞灶形成、蜂窝状改变,病理改变转向肺间质和肺泡结构重塑。肺组织弹性下降,顺应性降低,呼吸功能进一步恶化,患者活动耐力明显下降。
6、影像学特征
HRCT表现与病灶演变:HRCT显示网格影、牵拉性支气管扩张,急性期渗出逐渐转化为纤维化病灶。影像学动态变化有助于评估病情和治疗效果。
7、肺功能检查
限制性通气功能障碍,DLCO下降,反映肺组织损伤和纤维化程度。肺功能指标是评估病情和预后的重要依据。
8、实验室检查
血清标志物:血清KL- 6、SP- D水平升高,提示肺泡上皮损伤和炎症反应,辅助诊断。血清标志物动态监测可反映病情变化和治疗反应。
9、药物治疗
除基础的抗病毒治疗外,还要考虑:
1)抗纤维化药物:吡非尼酮、尼达尼布可延缓纤维化进展,改善肺功能,提高生活质量。抗纤维化药物需长期使用,定期评估疗效和安全性。
2)糖皮质激素的争议与使用时机:糖皮质激素对PVPF疗效有限,需谨慎使用,适用于急性加重期或炎症明显者。激素使用需权衡利弊,避免长期大剂量导致不良反应。
3)免疫调节剂:JAK抑制剂、抗IL- 6受体抗体调节免疫反应,减轻炎症和纤维化,但需进一步研究。免疫调节剂为治疗提供新思路,但需关注其潜在风险。
4)干细胞治疗、靶向TGF- β药物等新兴疗法在研究中,有望为PVPF治疗带来突破。新兴疗法需更多临床试验验证其疗效和安全性。
10、非药物治疗
氧疗与肺康复训练:氧疗改善低氧血症,肺康复训练提高活动耐力,改善生活质量。非药物治疗是综合管理的重要组成部分。
肺移植的适应症:肺移植适用于终末期肺纤维化患者,需严格评估适应症和手术风险。肺移植可改善预后,但供体短缺和术后并发症是挑战。
11、长期随访:多学科协作与患者教育
多学科协作团队包括呼吸科、影像科、康复科等,为患者提供全面管理。患者教育包括戒烟、疫苗接种等,减少感染风险,延缓病情进展。
专家简介

顾兴
空军军医大学硕士生导师,曾在第四军医大学唐都医院工作近 20 年,2020 年 1 月-7 月在唐都医院呼吸与危重症医学科负责 RICU 病区,熟悉呼吸与危重症医学科各种疾病的诊治, 现任西安市胸科医院呼吸与危重症医学科主任,陕西保健学会呼吸专业委员会呼吸介入学组负责人,陕西保健学会睡眠障碍学组副主任委员,西安市医疗事故鉴定委员会专家库成员,中国肺癌防治联盟青年委员,全军呼吸内科学专业委员会介入学组委员,发表中英文论著 10 余篇,参编介入专著3部,参与主持陕西省重点研发课题 1 项,西安市科技局重大课题 1项,兼任《国际呼吸杂志》编委。

王莉
副主任医师,空军军医大学硕士研究生,曾于陕西省人民医院呼吸与危重症科工作。西安医学会重症分会委员、西安医学会肝病学分会委员、陕西省保健学会委员,具有呼吸内科学及重症医学执业资格。熟练掌握常见疾病的独立诊断、治疗技能,对于慢性阻塞性肺疾病、肺心病、支气管哮喘、支气管扩张、肺纤维化、支气管肺癌等的诊断治疗逐步形成自己的认知与见解。熟练掌握中心静脉置管、支气管镜下吸痰、呼吸机、CRRT等操作,特别是各种气道和肺疾病导致的急慢性呼吸衰竭等的生命支持技术、临床诊断鉴别诊断技术和救治技术。发表中英文论著6篇。
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry
