对于一直以来萦绕通用CAR-T疗法疗效持久性的疑云,被先驱公司Allogene Therapeutics最新数据驱散。
近日,Allogene公布了其靶向CD19的通用CAR-T(ALLO-501A)治疗复发/难治性大B细胞淋巴瘤((R/R)LBCL)的一项Ⅰ期ALPHA和ALPHA2临床数据。这款疗法不仅展现出与自体CAR-T相媲美的长期缓解力,并且安全性可控,没有通用CAR-T常见的严重副作用。
据新闻稿所称,该是迄今为止通用CAR-T在LBCL患者群体中最大规模的临床研究,也是目前时间最长的随访数据。
受该临床数据鼓舞,Allogene股价大涨45%。
里程碑式的进步?
ALLO-501A是ALLO-501的进化产品,其区别在于ALLO-501A消除了ALLO-501中利妥昔单抗识别域。另外,为了避免通用CAR-T移植物抗宿主病(GVHD)和异基因排斥反应,利用了TALEN基因编辑技术对ALLO-501的CAR-T细胞进行了TCR和CD52基因的敲除。

ALPHA/ALPHA2是一项单臂、多中心、开放标签的Ⅰ期临床试验,此次公布的临床数据来自于其中33名R/RLBCL患者。
在这临床试验中,ALLO-501A所取得的ORR和CR与已被批准R/R LBCL的自体CD19 CAR T疗法一致,总缓解率(ORR)为58%,完全缓解率(CR)为42%。此外,试验结果显示,ALLO-501A在肿瘤负荷较低的患者治疗效果尤为显著,完全缓解率达到了100%(6)。
这项临床中最引人注目的是展现的疗效持久性数据。在获得CR的患者中,其中位缓解持续时间、无进展生存期分别达到了 23.1个月、24个月。Allogene的首席医疗官指出,还有多名患者的CR持续时间超过四年,通用CAR-T是否能带来持久缓解这个挥之不去的问题如今已得到了答案。
在通用CAR-T领域,持久性一直以来都是一个棘手问题。大多数通用CAR-T在缓解后不到六个月就复发了,更有甚者挺不过3个月。因此,先前即便有通用CAR-T不错的响应率,但是市场通常不敢过于乐观。
此外,ALLO-501A的安全性可控,没有出现严重的副作用,整体不良反应与已获批准的自体CD19 CAR T疗法一致,并未出现剂量限制性毒性、移植物抗宿主病 (GvHD)、免疫效应细胞相关神经毒性综合征 (ICANS) 或高级细胞因子释放综合征 (CRS)。
现金消耗挑战
Allogene是一家明星通用CAR-T公司,由前Kite高管于2017年创立,2018年便在纳斯达克上市。
Allogene布局了多款通用CAR T管线,适应症涵盖了血液肿瘤和实体瘤。
虽然此次的临床数据不错,但是ALLO-501A的临床进度算不上快,2020年6月,就启动了ALPHA I/II期临床,后来经历了“染色体异常”的风波而遭临床搁置,去年因为慢性淋巴细胞白血病(CLL)患者入组缓慢—ALPHA2,公司还放弃了该适应症的开发。
除了ALLO-501A之外,Allogene仅有一款进入临床的管线ALLO-316,一款靶向CD70的通用CAR-T,被开发用于治疗肾细胞癌(RCC),目前正进行Ⅰ期临床试验。
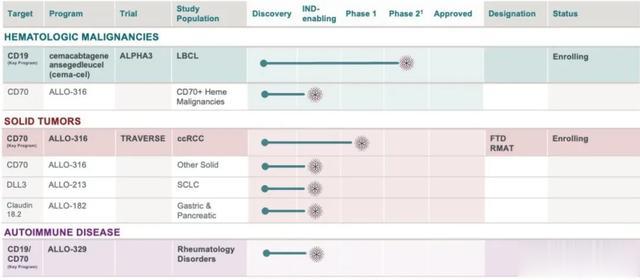
Allogene还有一个IND阶段的管线ALLO-329,针对自身免疫病,两个处于临床前通用细胞疗法ALLO-213、ALLO-182,针对实体瘤。
不过,Allogene的当务之急,仍然要考虑眼下的钱该如何用,ALLO-501A的ALPHA3临床试验预计将在2026年上半年才能完成对患者招募,在2026年底公布临床结果。ALLO-316S处于更早的阶段,距离获得批准还有很长的路要走。
而以Allogene当前的现金流消耗情况,对于维持到ALLO-501A Ⅲ期临床数据读出颇具挑战。根据2024年Q3财报,该季度净亏损为6630万美元,研发费用为4470万美元。截至2024年9月30日,公司拥有现金、现金等价物和投资4.034亿美元,预计能支持公司运营至2026年下半年。
参考出处
https://ir.allogene.com/news-releases/news-release-details/allogene-therapeutics-announces-publication-durable-response
“通用CAR-T染色体异常”安全警报解除?FDA同意恢复Allogene公司临床试验通用CAR-T停止一适应症开发—END—
