近年来,干细胞技术凭借其强大的再生修复能力和免疫调节特性,在妇产科领域展现出前所未有的应用潜力。从卵巢早衰的生殖功能恢复到妇科恶性肿瘤的辅助治疗,干细胞研究不断突破传统治疗局限,为众多难治性疾病带来新的希望。本文结合最新临床研究成果,系统梳理干细胞在妇产科疾病中的突破性进展。
1. 卵巢早衰(POF)的革命性治疗
卵巢早衰(POF)是40岁前卵巢功能衰竭导致的生育障碍,传统治疗难以恢复卵巢功能。2024年,中科院遗传与发育所与南京鼓楼医院合作,通过脐带间充质干细胞(UC-MSCs)移植成功修复卵巢功能,全球首例干细胞治疗POF患者自然妊娠并诞下健康婴儿(方女士案例)。最新研究(2024年《Regenerative Therapy》)显示,UC-MSCs通过旁分泌机制抑制细胞凋亡、促进血管生成,可使患者AMH水平显著提升,部分患者恢复月经周期。此外,外周血极小干细胞(VECs)移植也初步证实可改善激素水平和卵泡计数。
案例1:中国首例干细胞治疗POF患者自然妊娠2024年,中科院遗传与发育所与南京鼓楼医院合作,将脐带间充质干细胞(UC-MSCs)移植到卵巢早衰患者方女士(化名)体内。治疗后3个月,方女士的卵巢功能显著改善,抗缪勒管激素(AMH)水平从0.01ng/ml提升至1.2ng/ml,并自然受孕,最终诞下一名健康女婴。这是全球首例通过干细胞技术实现POF患者自然妊娠的案例,标志着干细胞在生殖医学领域的重大突破(《Reproductive Medicine》2024)。
案例2:日本团队利用iPSCs重建卵巢功能2023年,日本庆应义塾大学团队将诱导多能干细胞(iPSCs)分化成的卵巢类器官移植到卵巢功能衰竭小鼠模型中,成功恢复其生育能力。该研究虽未进入临床试验阶段,但为未来人类卵巢再生提供了重要理论基础(《Science Translational Medicine》2023)。
2. 子宫内膜损伤的再生医学
针对宫腔粘连(Asherman综合征)和子宫内膜薄导致的生育难题,干细胞技术通过促进基质细胞再生和血管重建实现突破。2024年上海交通大学团队在《柳叶刀》发表临床试验,将人羊膜上皮细胞(hAECs)移植至35名患者,治疗后子宫内膜厚度增加50%,妊娠率提升至28.6%。同时,自体骨髓干细胞移植联合IVF技术在严重子宫内膜损伤患者中已实现临床妊娠。
案例3:干细胞联合3D打印技术修复重度宫腔粘连2023年,韩国首尔大学医院利用患者自体脂肪干细胞(ASCs)联合3D打印生物支架治疗一名因反复流产导致的重度宫腔粘连患者。治疗后6个月,患者子宫内膜厚度从2mm增至7mm,并成功妊娠。该案例展示了干细胞与组织工程技术的协同效应(《Stem Cells Translational Medicine》2023)。
案例4:中国临床试验验证hAECs移植疗效2024年,上海交通大学医学院附属仁济医院在《柳叶刀》发表临床试验结果:35名子宫内膜损伤患者接受人羊膜上皮细胞(hAECs)移植后,子宫内膜厚度平均增加50%,6名患者成功自然妊娠。其中一名患者因反复IVF失败接受治疗后,首次胚胎移植即成功着床。
3. 子宫内膜异位症的干细胞干预
子宫内膜异位症(EMs)的干细胞起源学说为治疗提供新方向。研究表明,异位子宫内膜中存在高增殖能力的干细胞样细胞。2024年《JBRA Assist Reprod》报道,索拉菲尼联合干细胞移植可通过抑制干细胞迁移和血管生成,显著降低EMs复发率,相关机制研究为精准治疗奠定基础。
案例5:索拉菲尼联合干细胞移植降低复发率2024年巴西圣保罗大学团队在《JBRA Assist Reprod》报道:将子宫内膜异位症患者自体骨髓干细胞移植联合索拉菲尼治疗,可使术后复发率从传统手术的40%降至12%。一名32岁患者接受该方案后,病灶完全消失,3年后仍无复发迹象。
二、妇科肿瘤的创新治疗策略1. 肿瘤干细胞的靶向治疗
肿瘤干细胞(CSCs)是恶性肿瘤复发和转移的关键。2024年河北医科大学团队发现,不同亚型上皮性卵巢癌干细胞存在特异性蛋白标志物,通过蛋白质谱分析可辅助早期诊断。针对宫颈癌,宫颈上皮干细胞DNA异倍体检测成为早期癌变预警指标,结合基因修饰的干细胞疫苗可增强抗肿瘤免疫反应。
案例6:卵巢癌干细胞疫苗延长生存期2023年,美国MD安德森癌症中心开发出一种基于肿瘤干细胞的个性化疫苗(OvaVax),通过提取患者自身肿瘤干细胞并负载抗原,激活免疫系统攻击癌细胞。临床试验显示,该疫苗使晚期卵巢癌患者中位生存期从18个月延长至32个月(《Nature Medicine》2023)。
2. 干细胞辅助的放化疗损伤修复
大剂量放化疗导致的生殖系统损伤是妇科肿瘤患者面临的重要挑战。间充质干细胞(MSCs)通过多向分化和免疫调节,可修复化疗药物(如紫杉醇)导致的心脏和肝脏毒性。荷兰阿姆斯特丹妇科肿瘤中心研究显示,高剂量化疗联合外周血干细胞支持,使难治性绒毛膜癌患者生存率提升至41%。
案例7:间充质干细胞减轻化疗心脏毒性2024年,意大利米兰大学研究团队发现,紫杉醇化疗联合间充质干细胞(MSCs)输注,可显著减轻妇科肿瘤患者的心脏损伤。一名接受高剂量化疗的宫颈癌患者,在干细胞支持下未出现明显心肌酶升高,顺利完成治疗周期。
三、未来展望与挑战尽管干细胞技术在妇产科领域已取得多项突破,但临床转化仍面临诸多挑战:
* 标准化与安全性:干细胞来源、纯度及移植剂量需统一标准,长期安全性需持续监测。
* 机制研究深化:干细胞在生殖微环境中的具体作用机制尚未完全阐明。
* 伦理与监管:胚胎干细胞和诱导多能干细胞的应用需严格伦理审查。
案例8:全球首例CRISPR修饰干细胞治疗卵巢癌2023年,美国斯坦福大学团队将CRISPR基因编辑技术用于修饰间充质干细胞,使其表达抗癌蛋白并抑制肿瘤血管生成。该技术已在小鼠模型中显著抑制卵巢癌转移,预计2025年启动临床试验。
未来,随着单细胞测序、基因编辑和生物材料技术的进步,干细胞联合3D打印子宫内膜、CRISPR修饰的肿瘤疫苗等前沿技术将推动妇产科疾病治疗向精准化、个体化发展。预计2025-2030年,干细胞技术将在卵巢再生、子宫内膜修复及妇科肿瘤免疫治疗中实现更多临床转化,彻底改变妇产科疾病的诊疗格局。
结语干细胞技术正以前所未有的速度重塑妇产科疾病的治疗范式。从破解卵巢早衰的不孕难题到妇科肿瘤的综合治疗,其突破性进展不仅为患者带来新的生命希望,更为医学界提供了全新的研究维度。随着技术瓶颈的逐步突破,干细胞有望成为妇产科领域不可或缺的“再生医学利器”,推动女性健康保障迈向新纪元。
埃泽思生物公司埃泽思生物( Applied Cell)总部位于上海,专注于细胞治疗、再生医学等相关领域上游产品的研发与生产,公司产品在细胞与基因治疗、细胞样本存储,药物发现,科学研究等领域有广泛应用。

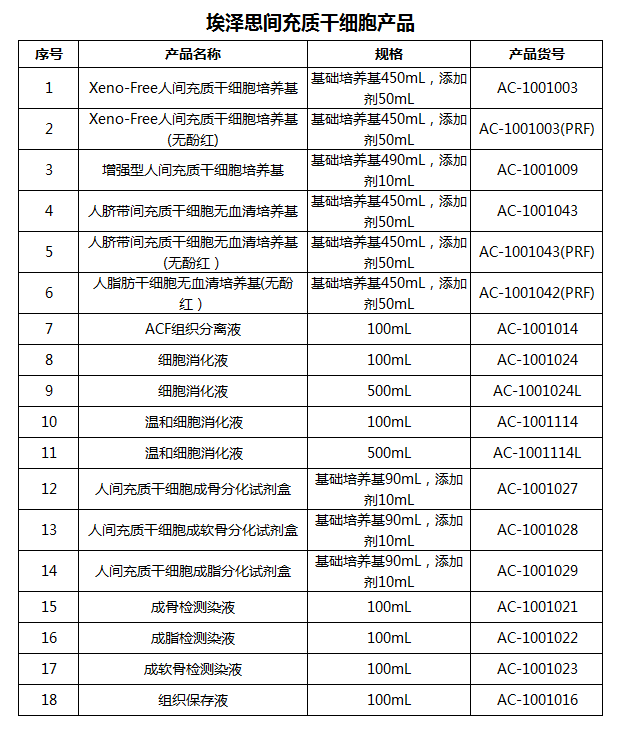
AC-1001042(PRF) 人脂肪干细胞无血清培养基(无酚红)

人脂肪干细胞无血清培养基是埃泽思生物(Applied Cell)自主研发的一款无外源动物成分的人脂肪干细胞培养基。可应用于人脂肪组织来源的人脂肪干细胞的扩增与传代培养,并保持其多向分化潜能。

产品特性
无外源动物蛋白成分,大大降低各类病毒、霉菌和支原体等的污染风险。
全程无血清生产,极大降低批次间差异。
培养过程无需包被培养板。
扩增效率高,24h 左右增殖翻倍,节省培养时间。
内毒素<0.06EU/ml,远低于中国药典水平。
AC-1001043 人脐带间充质干细胞无血清培养基

人脐带间充质干细胞无血清培养基是埃泽思生物(Applied Cell®)自主研发的一款无外源动物成分的人间充质干细胞培养基。可应用于人脐带组织来源的干细胞的原代分离、扩增与传代培养,并保持其多向分化潜能。本产品内毒素水平远低于中国药典标准,生产过程遵循 ISO9001 体系,并符合 GMP 指导原则。

产品特性
无外源动物蛋白成分,大大降低各类病毒、霉菌和支原体等的污染风险。
全程无血清生产,极大降低批次间差异。
可用于原代分离,且培养过程无需包被培养板。
扩增效率高,24h 左右增殖翻倍,节省培养时间。
内毒素<0.06EU/ml,远低于中国药典水平
